Si la metanfetamina no ingresa al cerebro, no puede causar efectos psicoactivos. Ese es el razonamiento en el que se basa un enfoque de tratamiento novedoso que han aplicado unos investigadores apoyados por el NIDA en la Universidad de Arkansas para Ciencias Médicas (UAMS, por su sigla en inglés) y la compañía de biotecnología InterveXion Therapeutics (IXT).
Conjuntamente con sus colegas, los Dres. Michael Owens y Brooks Gentry han creado un anticuerpo monoclonal (mAb) destinado a interactuar con la metanfetamina y disminuir su capacidad de ingresar al cerebro. Ellos han realizados pruebas exitosas con el anticuerpo, denominado IXT-m200, tanto in vitro como en animales, y ahora su desarrollo ha avanzado hasta la segunda y penúltima etapa de los ensayos clínicos. Si todo sigue saliendo bien, ellos esperan ponerlo a disposición de médicos y pacientes en unos 3 a 5 años. Este artículo describe su recorrido de 20 años hasta llegar a este punto, así como el trabajo que aún queda por hacer.
Un anticuerpo contra la metanfetamina
En general, los anticuerpos ayudan al sistema inmune a detectar y destruir moléculas foráneas o nocivas. El equipo de UAMS-IXT diseñó el IXT-m200 utilizando tecnología que permite que los investigadores diseñen anticuerpos específicos, los mAb, contra casi cualquier molécula (vea "Cómo elaborar un anticuerpo monoclonal"). Los mAb específicos que crearon son a su vez anticuerpos quiméricos, ya que se desarrollaron sobre una base de anticuerpos de ratón a la que se añaderon partes de anticuerpos humanos para que sean aceptables para el sistema inmune humano y no induzcan una respuesta inmune. Además, mantienen la capacidad de ligarse fuertemente a la metanfetamina. Cuando se administra a un paciente, los mAb se gravitan en gran concentración hacia su molécula objetivo, en este caso, la metanfetamina, se ligan a esta y disminuyen su capacidad para entrar al cerebro.
Desde su descubrimiento en la década de los setenta, los mAb han servido como herramientas de investigación y diagnóstico en los laboratorios y las clínicas; actualmente, algunos se usan para tratar el cáncer, la artritis reumatoide y muchas otras enfermedades. El Dr. Owens y sus colegas pensaron que esta estrategia de ligación también podría funcionar para reducir los efectos nocivos de las drogas de abuso. Una vez inyectado, el IXT-m200 atrapa y sujeta la metanfetamina que ya está dentro o posteriormente ingresa al torrente sanguíneo. Debido a que el IXT-m200 es demasiado grande para pasar a través de la barrera hematoencefálica, la droga captada permanece en la sangre, desde donde es transportada al riñón y al hígado para su eliminación.
El Dr. Owens explica cómo los investigadores piensan que el IXT-m200 puede ayudar a los pacientes a superar la adicción, afirmando que las personas consumen metanfetamina por el efecto placentero o la euforia intensa e inmediata que obtienen cuando la fuman, inhalan o inyectan, y se espera que el anticuerpo disminuya esos efectos. Con esto, podría disminuir la motivación para consumir la droga y aumentar el compromiso de los pacientes con el tratamiento y la abstinencia, especialmente si también están en terapia cognitivo-conductual ("terapia de diálogo").
Los investigadores prevén que el IXT-m200 se usará sobre todo como un complemento para ayudar a los pacientes a permanecer en terapia conductual. Muchos pacientes con trastorno por consumo de metanfetamina abandonan el tratamiento prematuramente, a pesar de que los estudios han demostrado que cuanto más tiempo continúan en tratamiento, mayor es la probabilidad de que logren una abstinencia sostenida. El Dr. Gentry explica que conciben un escenario clínico en el que se administraría el anticuerpo una vez al mes en un entorno ambulatorio. Él manifestó que cuando una persona recae en el consumo de metanfetamina, el anticuerpo reducirá la velocidad con la que la droga llegaría al cerebro, por lo que esperan que también disminuya sus efectos placenteros de refuerzo. Él cree que el anticuerpo cambiará los efectos de la droga, de manera que los pacientes tendrán una mayor probabilidad de regresar al programa de rehabilitación, acortando el proceso para dejar de consumir la droga.
El Dr. Owens añadió que esto no es una poción mágica, sino un complemento que a nadie se le había ocurrido todavía.
El inicio
Fue en la década de los ochenta cuando el Dr. Owens inició sus esfuerzos hacia el desarrollo del IXT-m200. Recién había terminado su doctorado en la Universidad de Carolina del Norte (UNC, por su siglas en inglés) y comenzó a trabajar en el laboratorio del Dr. Michael Mayersohn, en la Universidad de Arizona, donde estaban estudiando cómo el cuerpo metaboliza la droga fenciclidina (PCP, por sus siglas en inglés). El Dr. Owens recuerda que el Dr. Mayersohn le preguntó si creía que podría desarrollar anticuerpos para tratar una sobredosis. Él acababa de asistir a una conferencia sobre anticuerpos monoclonales antes de dejar la UNC y le respondió que pensaba que podría ser posible, pero que tendrían que contar con anticuerpos monoclonales, en lugar de simplemente policlonales, para lograr concentraciones más altas de anticuerpos y efectos inmediatos. El Dr. Owens asevera que así fue como empezó todo este proceso.
El equipo de Arizona desarrolló varios mAb contra la PCP y el Dr. Owens continuó con este trabajo cuando estableció su propio laboratorio en la UAMS en 1986. Si bien se descubrió un excelente anticuerpo para la PCP y se sometió a prueba con éxito en animales, la disminución en las tasas de consumo y adicción a la PCP les hizo abandonar ese proyecto. El problema ya no justificaba el extenso y costoso proceso para desarrollar un medicamento.
En 1994, el Dr. Gentry se integró al grupo del Dr. Owens. Cuando el consumo y la adicción a la metanfetamina aumentaron desenfrenadamente a mediados de la década de los noventa, los investigadores vieron una posible oportunidad para aprovechar los mAb. El Dr. Gentry explicó que, en ese momento, la metanfetamina era una droga de abuso que en su mayoría se producía localmente y Arkansas era el estado con un mayor número de laboratorios de metanfetamina per cápita en los Estados Unidos. Él recalcó que reconocieron que probablemente la adicción a esta droga era un problema a largo plazo y de acción prolongada, para el cual un antagonista de acción prolongada, como un anticuerpo monoclonal, podría ser eficaz.
En 1999, los investigadores obtuvieron su primera subvención del NIDA para esta investigación y, después de 5 años, tuvieron la certeza suficiente de que estaban bien encaminados, por lo que fundaron InterveXion, a fin de facilitar un mayor desarrollo de fármacos. La inclusión de otros tres científicos muy establecidos, los Dres. Ralph Henry, Misty Stevens y Keith Ward, ha sido fundamental para el éxito de InterveXion. Juntos, este grupo se dio cuenta de que formar una empresa les permitiría solicitar subvenciones para pequeñas empresas y también les ofrecería la oportunidad de buscar subvenciones más cuantiosas que serían necesarias para realizar ensayos clínicos. También reconocieron que era poco probable que las compañías farmacéuticas tradicionales invirtieran en la terapia de mAb para la adicción a las drogas sin datos clínicos que demostraran la viabilidad del concepto. Su equipo estaba preparado para realizar ensayos clínicos para validar esto.
Aprendizaje de los animales
El equipo produjo y evaluó aproximadamente unos seis de sus mejores mAb contra la metanfetamina. Un actor clave en este proceso fue el Dr. Ivy Carroll, del Research Triangle Institute, quien sintetizó todos los haptenos para el proceso de descubrimiento de anticuerpos. Para lograr la eficacia del tratamiento, un anticuerpo debe ligarse estrechamente al fármaco (es decir, debe tener una alta afinidad) y mantenerlo en el torrente sanguíneo el tiempo suficiente para que el cuerpo lo descomponga o lo elimine. No todos los mAb del equipo cumplieron con estos criterios de la misma manera, especialmente cuando se sometieron a prueba en animales de laboratorio, en lugar de hacerlo en tubos de ensayo. El Dr. Owens recuerda que al principio descubrieron que su mejor anticuerpo, es decir, el que tenía la mayor afinidad que habían logrado crear, se inactivaba una vez que se inyectaba en los animales.
Después de varios años de crear y someter a prueba el mAb, el Dr. Owens y sus colegas determinaron que el IXT-m200 tenía los atributos más adecuados. Pruebas adicionales in vitro e in vivo en ratas establecieron que el IXT-m200 se desempeñaba como ellos aspiraban, sin ocasionar efectos secundarios no deseados. En animales, el IXT-m200:
- Tenía una gran afinidad por la metanfetamina y los estimulantes relacionados (anfetamina, MDMA), pero no por las propias moléculas de señalización del cuerpo (neurotransmisores), medicamentos importantes de venta libre u otras drogas de abuso.
- No se ligó a las moléculas del cuerpo que pueden desencadenar reacciones tóxicas (es decir, citotoxicidad dependiente de complemento).
- Se ligó a la metanfetamina en la sangre, evitando así que se propagara a los órganos, particularmente al cerebro.
- Tenía una vida media mucho más larga que la metanfetamina en ratas (aproximadamente nueve días frente a una hora), lo que indica que podría ligarse a la metanfetamina repetidamente. Esto sugería que el anticuerpo sería eficaz incluso si una persona tomaba varias dosis de metanfetamina para superar los efectos del anticuerpo.
- Redujo la gravedad y la duración de los efectos estimulantes de la metanfetamina.
Los resultados de las pruebas in vitro y en animales del Dr. Owens y sus colegas dieron origen a la aprobación de la Administración de Alimentos y Medicamentos de los Estados Unidos para someter a prueba el IXT-m200 en seres humanos en 2013. Los resultados de estos ensayos clínicos hasta la fecha y el proceso de desarrollo en el futuro se destacan en la parte 2 de esta serie de artículos.
Cómo elaborar un anticuerpo monoclonal
El sistema inmune utiliza anticuerpos para identificar moléculas foráneas o nocivas, ligarse a ellas y, de ese modo, marcarlas para su eliminación del cuerpo o para su destrucción por otros componentes del sistema inmune. Normalmente, cuando el cuerpo encuentra una molécula extraña, ciertas células inmunes (linfocitos B) producen numerosos anticuerpos ligeramente diferentes que, por lo general, se ligan a diferentes partes, o epítopos (determinantes antigénicos), de la molécula foránea.
En la década de los setenta, los investigadores aprendieron cómo aislar linfocitos B individuales que producían un solo anticuerpo específico que reconocía un epítopo específico. Esto les permitió seleccionar y desarrollar un gran número de células que producen exactamente el mismo anticuerpo: los anticuerpos monoclonales (mAb). Sus principales ventajas son que pueden producirse en grandes cantidades y que pueden ser altamente específicos para una determinada molécula objetivo, como la metanfetamina. En teoría, los anticuerpos monoclonales pueden producirse contra casi cualquier molécula de interés y pueden ocasionar su detección, inactivación o destrucción, por lo que son una herramienta muy valiosa tanto para fines de investigación como de tratamiento.
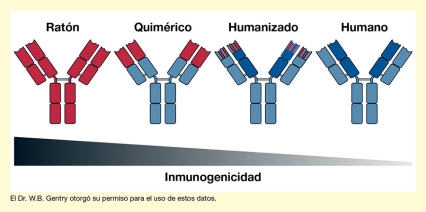
Los científicos también pueden rediseñar los anticuerpos producidos por ratones para lograr que se asemejen más a los anticuerpos humanos (es decir, reemplazar partes de ratones con las de humanos). Esto reduce el riesgo de que el sistema inmune humano los consideren como foráneos y los ataquen (es decir, se reduce la inmunogenicidad de los anticuerpos).
Dependiendo de la cantidad de partes de anticuerpos humanos introducidas, los mAb resultantes se denominan quiméricos o humanizados. El anticuerpo IXT-m200 de InterveXion es un mAb quimérico que contiene aproximadamente dos tercios de material humano. Como resultado de estos cambios, los anticuerpos quiméricos pueden administrarse a pacientes humanos en los que pueden captar metanfetamina, pero son mucho menos inmunogénicos que los anticuerpos de ratón. Actualmente, hay tratamientos basados en los mAb disponibles para varios trastornos, incluidos ciertos tipos de cáncer y trastornos autoinmunitarios como la artritis reumatoide.
Este estudio contó con el apoyo de las subvenciones DA031944, DA028915, DA037593 y DA045366 de los NIH.
- Texto descriptivo de la imagen
La figura muestra la estructura general de cuatro tipos de anticuerpos (de izquierda a derecha): de ratón, quiméricos, humanizados y humanos. Los componentes de los anticuerpos derivados de ratones se muestran en rojo, mientras que los componentes derivados de humanos se muestran en azul. Todos los anticuerpos tienen una estructura en forma de Y, con cuatro secciones (dispuestas en 2x2) que forman el tronco y cuatro secciones (dispuestas en 2x2) que forman los dos brazos de la Y. En el anticuerpo de la izquierda, todas sus 12 secciones son rojas, lo que indica que son derivadas de ratones. Para el anticuerpo quimérico (segundo de la izquierda), las cuatro secciones del tronco y las dos secciones inferiores de cada brazo son azules, lo que indica que son derivadas de humanos, y las dos secciones superiores de cada brazo son rojas, lo que indica que son derivadas de ratones. Para el anticuerpo humanizado (segundo de la derecha), las cuatro secciones del tronco, las dos secciones inferiores de cada brazo y la mitad de las dos secciones superiores de cada brazo son azules, lo que indica que son derivadas de humanos. La mitad superior de las dos secciones superiores de cada brazo tiene rayas rojas y azules, lo que indica que se derivan parcialmente de ratones y de seres humanos. En el anticuerpo humano a la derecha, todas las secciones son azules. Un triángulo con tonos degradados de negro a gris, que apunta hacia la derecha debajo de las cuatro moléculas de anticuerpos, indica la disminución progresiva de la inmunogenicidad al pasar del anticuerpo de ratón a los anticuerpos quiméricos, humanizados y humanos.
Fuente:
- Stevens, M.W., Tawney, R.L., West, C.M., et al. Preclinical characterization of an anti-methamphetamine monoclonal antibody for human use. mAbs 6(2):547-555, 2014.